格氏试剂是有机合成中应用最为广泛的试剂之一,它是1901年由法国化学家格林尼亚(Victor Grignard)发现的,他因此而获得1912年诺贝尔化学奖。卤代物在无水乙醚或四氢呋喃中和金属镁作用生成烷基卤化镁RMgX,这种有机镁化合物被称作格氏试剂(Grignard Reagent)。格氏试剂作为亲核试剂可以与醛、酮、羧酸等化合物发生加成反应,这类反应被称作格氏反应(Grignard Reaction)。格氏试剂一经发现,此反应就成为非常重要的C-C键形成的方法。
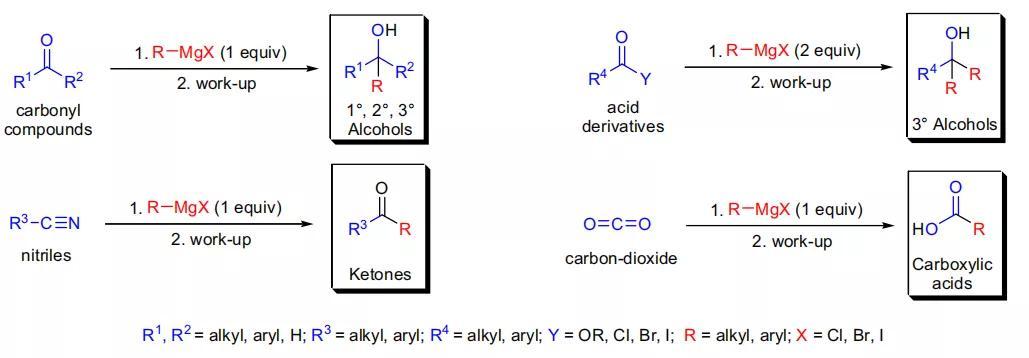
反应特点:一、格氏试剂主要通过烷基、芳基、或烯基卤代烷烃和镁金属在非质子亲核溶剂(乙醚或THF)中制备得到;二、格氏试剂通常热稳定,但是对空气和水敏感,与质子性基团不兼容(如,醇,硫醇,酚,羧酸,1°, 2° 胺,端基炔);三、C-Mg键高度极化,C原子带部分负电荷,因此格氏试剂是非常优秀的碳亲核试剂(制备格氏试剂的卤代烃碳带有部分正电荷,制备格氏试剂的过程中极性反转);四、与格氏试剂反应的底物一般含有碳-杂原子多键,因此碳上带有部分正电荷,与亲核的格氏试剂反应很容易进行;五、与一个当量的格氏反应后,醛可以得到仲醇(甲醛得到伯醇),酮得到叔醇,腈得到酮,二氧化碳得到羧酸;六、羧酸类衍生物和两个当量格氏试剂反应:酯和酰氯转化为叔醇;七、由于羰基的两面都发生加成,前手性醛和酮与非手性格氏试剂反应后得到的是相应醇的外消旋混合物。八、手性底物会生成非对映体混合物,如Felkin-Anh模型或螯合控制模型【Cram规则和Felkin-Anh规则】所预测的那样,会形成一个主要的非对映体。九、卤代烷烃可以和格氏试剂发生武兹反应得到烷烃,和环氧化物可以在取代基较少的一侧进行SN2反应。
格氏试剂生成的活性顺序:当卤素相同时:烯丙基卤代烃>叔卤代烷>仲卤代烷>伯卤代烷>卤代芳烃(R·自由基越稳定则越易形成,反应越容易进行)。当烷基相同时 R-I > R-Br > R-Cl。由于碘代烷最贵,而氯代烷的反应性最差,所以,实验室中常采用反应性居中的溴代烷来合成格氏试剂。格氏试剂非常活泼,可以和空气中的氧、水、二氧化碳发生反应。因此,在制备时,除保持试剂的干燥外,还应隔绝空气。格氏试剂是有机合成中非常重要的试剂之一。制得的格氏试剂不需分离即可直接用于有机合成。
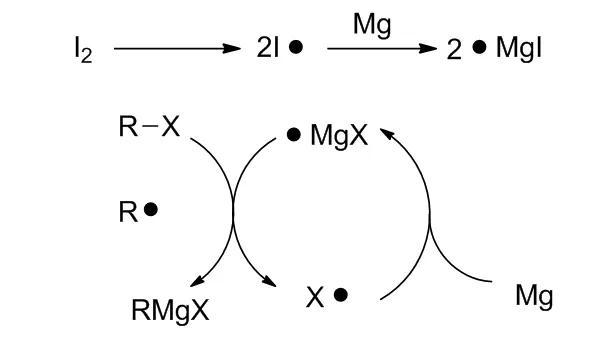
试剂的制备:在乙醚中,直接用镁屑(尽量不要用镁粉,因为反应太剧烈,另外镁粉表面容易形成氧化膜)跟卤代烷反应。活泼卤代烷可直接加热引发,不太活泼的卤代烷可加入少量碘或者1,2-二溴乙烷来引发。如果反应液呈现混浊状并且温度上升,表明反应已经开始。如果没有产生上述现象,则需要继续加入一点引发剂,可稍稍加热,温度不能过高。反应开始后,应该停止加热,因为这个反应为放热反应。引发后温度会较高,容易发生偶联(Wurtz Reaction),应降低温度。
通常情况下,当卤代化合物不太活泼时,也可以用活性较高的格式试剂通过交换来制备。
在格氏试剂制备的过程中,无水是最重要的反应条件,否则会使生成的格氏试剂水解而失活,所以要用无水溶剂,反应体系应该用惰性气体保护。镁的使用也要注意。一般采用纯Mg条或者镁屑以减少副反应的发生,纯度低的Mg会降低格氏试剂的产率长期放置的镁条要先用稀盐酸除去表面的氧化膜,然后依次用乙醇与乙醚洗涤后干燥,用量一般为过量5%-10%。格氏试剂也可以与氧气、CO2反应,所以也应该避免。
格氏反应中常见的副反应:一、制备格氏试剂时,生成的试剂会和卤代物进行Wurtz反应进行偶联(减慢滴加卤代物的速度,控制温度不要太高);二、格氏反应中无水无氧条件不严格时,会和水反应生成烷烃,和氧气反应生成烷氧化物;三、羰基化合物含有α-H时,底物会进行烯醇化;四、含有β-H的格氏试剂和位阻较大的羰基化合物进行反应时,有可能发生分子间的氢转移,将羰基化合物还原。
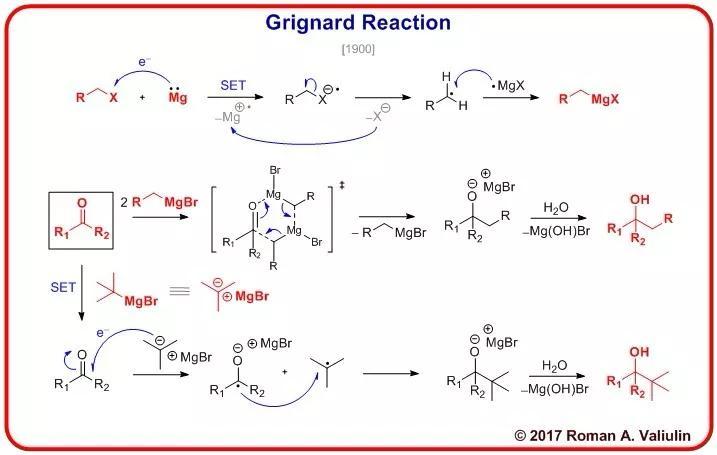
反应机理
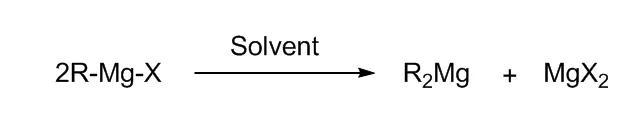
在反应液中格氏试剂不只是以RMgX的形式单独存在,而是R:Mg,MgX ,(RMgx)n等多种物质的混合物,各物质在溶液中存在动态平衡。通常情况下,大部分的格氏试剂在溶剂中以四面体和三角双锥分子结的形式存在。